El 37 % de las actualizaciones se hacen para productos oncológicos
La incorporación de una molécula al Cuadro Básico de Medicamentos Esenciales (CBME) y su disponibilidad para los pacientes se toma, en promedio, unos cinco años (67 meses) desde el momento de su aprobación por la Agencia Europea de Medicamentos (EMA) o la Agencia de Administración de Alimentos y Medicamentos en Estados Unidos (FDA).
Así lo determinó el estudio WAIT para pacientes (Waiting to access innovative therapies, o En espera de recibir terapias innovadoras), el cual mide la tasa de disponibilidad de medicamentos innovadores en más de 30 países.
La Federación Latinoamericana de Industria Farmacéutica (Fifarma), optó por desarrollar este estudio en 10 países de América Latina y el Caribe para conocer la realidad de la región, incluyendo a: Perú, Brasil, Panamá, Costa Rica, Argentina, México, Chile, Colombia, Ecuador y República Dominicana.
El estudio incluyó el análisis de 403 moléculas innovadoras, aprobadas a nivel mundial desde el año 2014 a 2024, el 80 % de todos los productos aprobados en esa década.
El estudio abarcó el tratamiento en cinco áreas terapéuticas: oncología (32 %); inmunología y enfermedades inflamatorias (17 %); sistema nervioso central (14 %); enfermedades cardiometabólicas (7 %) y enfermedades huérfanas (13 %).
Los resultados fueron presentados por Oscar Courtney, director asociado de la firma IQVIA, la cual se encargó de procesar toda la data.
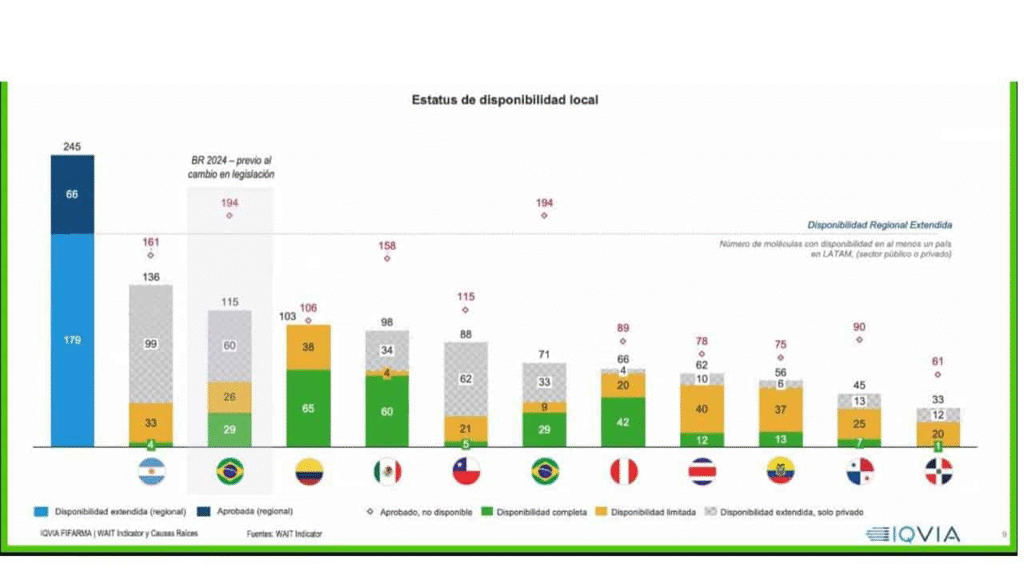
De acuerdo con Courtney, Brasil y Argentina tienen el mayor número de aprobaciones de todos los países examinados, con una mayor inversión hacia el gasto público. República Dominicana y Panamá fueron los que presentaron barreras en cuanto a la disponibilidad de data de parte de las instituciones públicas.
«La disponibilidad de data es una barrera importante. La transparencia de data ha sido un tema recurrente», comentó durante la socialización de los resultados a través de un foro virtual con periodistas latinos.
En general, el promedio en la región es de 39 meses para la aprobación de la nueva molécula y otros 29 meses hasta lograr su disponibilidad en farmacias, dispensarios o direcciones de medicamentos de alto costo.
Courtney definió el proceso como «largo y fragmentado», perjudicando al paciente quien puede empeorar su estado de salud mientras espera por el nuevo medicamento.
En el caso particular de República Dominicana, Courtney comentó que, de 2014 a 2024, en el país se aprobaron 61 moléculas innovadoras, de las cuales, 16 tienen disponibilidad limitada y 32 están disponibles solo de forma privada.
Esta cifra dista de países como Brasil que tuvo 194 aprobaciones, Argentina con 161 y 158 en México.
- Al comparar los años 2024 con 2025, el estudio estableció que en República Dominicana solo hubo un 7 % de mejoras en las moléculas (24 productos), manteniéndose el 93 % de manera estática (337 sin mejoras o una reducción en el acceso).
México obtuvo la mejor tasa de mejora con un 17 %.
«Varía mucho por producto, por molécula y entre países. En las moléculas públicas dominan las oncológicas, que están disponibles en el sector público (como la Dirección de Medicamentos de Alto Costo), las enfermedades huérfanas tienen poca cobertura, aunque tienen alta tasa de aprobación», precisó el investigador.
«Vemos una brecha entre las que están aprobadas y las que tienen disponibilidad. No está avanzando la aprobación de moléculas luego de la pandemia por Covid, como sucedía antes, en 2014″, agregó.
Destacó que, República Dominicana se encuentra dentro de los 10 países estudiados como uno de los de menor acceso por temas de presupuesto y gasto en salud, atribuido a que se necesita «experiencia, recursos humanos, capacitación, recursos técnicos para dar abasto al número de tecnología que va saliendo año con año» y así poder mantener las aprobaciones al día.
Fuente DIARIO LIBRE